| К. К. ГЕДРОЙЦ | ХИМИЧЕСКИЙ АНАЛИЗ ПОЧВ |
Определение количества в почвах азота нитратного и аммиачного при современной разработанности колориметрических методов лучше производить помощью этих методов ввиду малого содержания в почве этих соединений. Но так как, насколько нам известно, колориметрия применяется еще не во всех наших опытных учреждениях, то мы считаем не лишним дать здесь описание и яекодориметрических способов определения этих соединений.
Метод основан на измерении объема выделившейся окиси азота при кипячении нитратов с солью закиси железа в присутствии соляной кислоты; реакция протекает по уравнению: 2NaNO3+6FeCl2+8HCl = 6FeCl3+NaCl+4H2O+2NO.
Определение производится в приборе, состоящем из колбы, имеющей вместимость 200-300 к. стм. и закрывающейся каучуковой пробкой с двумя отверстиями; в одно из них вставляется разделительная воронка емкостью в 15-20 к. стм. с отводящей узкой трубкой, доходящей почти до дна колбы; во второе отверстие вставляется стеклянная трубка, служащая для отвода газа в газоизмерительную трубку; внутри колбы она оканчивается почти у самой пробки, наружная же часть ее изгибается под острым углом и соединяется кауч. трубкой со 2-ой стекл. трубкой, нижний конец которой изогнут вверх и подводится под газоизмерительную трубку. Колба укрепляется на штативе так, чтобы под нее можно было подвести горелку.
Ход анализа следующий: в колбу наливают 50 к. стм. насыщенного раствора хлористо-водородной соли закиси железа (соль можно употреблять или покупную или самому приготовить, растворив металлическое железо в соляной кислоте при нагревании) и 50 к. стм. 10% соляной кислоты; колбу закрывают вышеназванной пробкой и содержимое кипятят для удаления из колбы воздуха; когда это будет достигнуто (удален ли весь воздух из колбы, легко узнать, опустив газоотводную трубку в воду: отсутствие пузырьков укажет на полное отсутствие воздуха в колбе), подводят газоотводную трубку под газоизмерительную, наполненную сполна водой и опушенную в сосуд с водою, и постепенно, не прекращая нагревания, вливают в колбу через разделительную воронку исследуемую жидкость, после чего воронку ополаскивают три раза 10% соляной кислотой, вливая последнюю также каждый раз в колбу; во избежание прохода воздуха в колбу чрез воронку, последняя никогда не должна быть совсем опорожниваема; образующаяся в колбе окись азота вместе с парами соляной кислоты проходит чрез газоотводную трубку в газоизмерительную; когда выделение пузырьков и увеличение объема газа в газометрической трубке прекратится, то определение закончено; под газометрическую трубку подводят щипцами тигель и таким образом переносят ее в большой сосуд с дестиллированной водой, а газоотводную трубку подводят под вторую газометрическую трубку и приступают к следующему определению; таких определений, не прибавляя в колбу нового количества хлористого железа, можно сделать такое количество, чтобы общая сумма всей выделившейся окиси азота доходила до 700 к. стм., после чего уже колбу приходится заряжать сызнова. При описанном способе нельзя узнать количества азотной кислоты прямым определением объема выделившейся окиси азота, так как последняя, хотя и слабо, но все-таки растворима в воде; поэтому каждый раз необходимо рядом с определениями азотной кислоты в испытуемых веществах определить ее тем же способом и при возможно тех же условиях в известном объеме вполне определенного раствора селитры (обычно в 10 куб. стм. "нормального раствора": 2,5 rp.NaNO3 в 100 к. стм. жидкости); газометрическая трубка с окисью азота, полученной из этого раствора, переносится в тот же сосуд с водой, куда помещены газометрические трубки с окисью азота из испытуемых веществ; когда все они примут температуру воды этого сосуда, измеряют объем окиси азота в каждой из них (при этом необходимо газометрическую трубку установить так, чтобы уровни воды в сосуде и в этой трубке были на одной и той же высоте) и вычисляют содержание азота в исследуемом веществе на основании пропорции: x:N = v:V, где х искомое содержание азота во взятой навеске исследуемого вещества, N - известное содержание азота во взятой для анализа селитре, v и V объемы окиси азота, выделенной исследуемым веществом и селитрой.
Способ Schloesing-Wagner'a отличается от вышеописанного тем, что газоизмерительные трубки и ванна, куда они при определении погружаются, наполнены не водой, а 40% раствором едкой щелочи; в этом случае, вследствие нерастворимости окиси азота в этом растворе, можно непосредственно объем выделенной исследуемым веществом окиси азота, по приведению его к 0° и к нормальному барометрическому (760 ми.) давлению (поэтому при этом способе необходимо измерить при отсчете объема температуру и давление), перечислить на весовое количество азота или азотной кислоты (1 куб. стм. окиси азота при этих условиях соответствует 0,000627 гр. азота, или 0,002417 гр. N2O3, или 0,003805 гр. NaNO3). Приведение к 0° температуры и нормальному давлению делается по формуле:
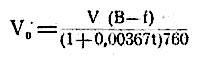
При определении величины навески почвы, необходимой для одиночного определения нитратного азота, можно руководствоваться следующими соображениями: в среднем можно считать, что в одном кгр. почвы содержится около 10 мгр. нитратного азота; один мгр. азота дает около 1,5 к. стм. (по приведению к 0° и нормальному давлению) окиси азота; при объеме выделившейся окиси азота около 10 к. стм., что соответствует около 6 мгр. нитратного азота, определение можно провести с совершенно достаточной точностью. Таким образом в среднем на одно определение нитратного азота нужна навеска почвы около 600 гр.; поэтому, считая два параллельных определения, вытяжку следует готовить из 1000-1500 гр. почвы. В этом случае, конечно, количество воды при приготовлении вытяжки должно быть не пятерное, а значительно меньше; вполне достаточно брать двойное количество воды. Отфильтрованная определенная часть вытяжки сгущается выпариванием до небольшого объема с прибавлением нескольких к. стм. концентрированного едкого натра или кали (во избежание улетучивания азотной кислоты), переносится в мерную колбу емкостью в 100 или 50 к. стм., колба дополняется до черты водою, и отсюда берут части для анализа.
Примечание. Наполнение обычных газоизмерительных трубок едкою щелочью - операция довольно неприятная (удобнее всего это производить таким образом: трубка наполняется щелочью так, чтобы на открытом конце ее получился выпуклый мениск; отверстие прикрывается кусочком фильтровальной бумаги, и трубка быстро переворачивается и опускается в ванну со щелочью); В. Сазанов рекомендует трубки с кранами, что позволяет при помощи каучуковой трубки прямо втягивать в них щелочь из ванны (Журн. Оп. Агр. 1906 стр. 381).
Способ Schloesing'a. Приготовляют из почвы слабосолянокислую вытяжку; Schloesing рекомендует для этого соляную кислоту около 6%; но так как в такой кислоте легкорастворимы не только аммонийные соединения почвы но и амидные, то лучше брать кислоту не выше 1%-ой. На 100 гр. почвы берут 400 к. стм. такой кислоты, взбалтывают и отфильтровывают. В соответствующей части фильтрата определяют аммиак отгонкой его в приемник с титрованной кислотой кипячением с прокаленной магнезией (1,5-2 гр. на 25 гр. почвы). Если в почве содержатся карбонаты, то они предварительно разрушаются соляной кислотою.